m6A是一种甲基化修饰,发生在RNA分子中的N6位置上,由甲基转移酶催化。m6A修饰可以影响RNA的稳定性、翻译效率和调控元件的识别,对于理解RNA的功能和调控具有重要的意义,也为研究新的生物学现象提供了新的思路。此外,m6A修饰还与许多疾病的发生和发展密切相关,对m6A修饰的研究可以为相关疾病的治疗提供新的思路和方法。因此,对RNA的m6A修饰的研究具有重要的意义。
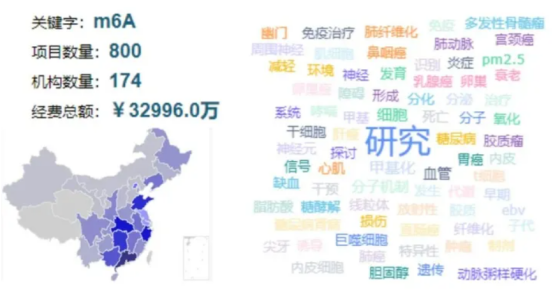
2021—2023年国自然基金m6A
1. m6A修饰动态调控
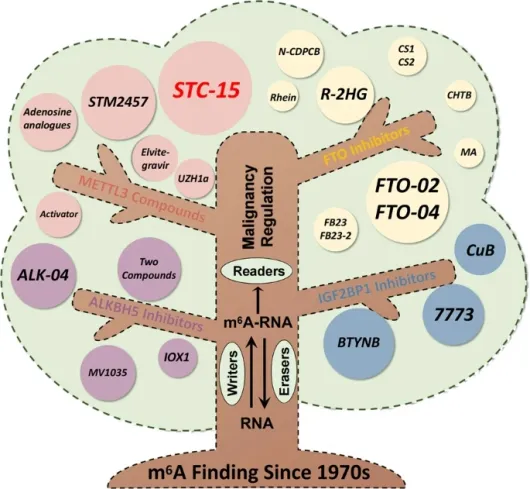
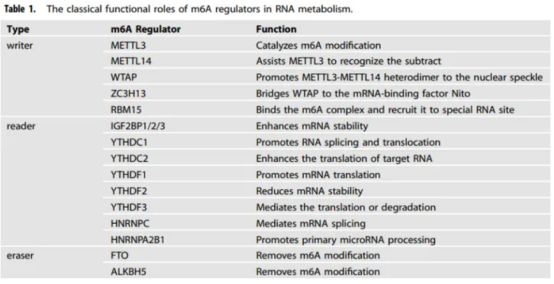
m6A修饰是真核细胞中常见的RNA修饰,它可以在不改变RNA碱基序列的前提下,对RNA的转录、加工、翻译等过程进行调控。整个修饰过程被认为是动态的、可逆的。m6A修饰的执行涉及三个关键因素,分别是“Writers”、“Erasers”、“Readers”。
1) Writers
m6A甲基化转移酶:由METTL3、METTL14和以WTAP为代表的辅酶因子组成的蛋白质复合物。这些蛋白共同协作,在RNA修饰中发挥重要作用。METTL3负责添加甲基,METTL14起调节和稳定作用,而WTAP等辅酶因子增强METTL3和METTL14的活性,并与其他蛋白相互作用以帮助RNA分子传递甲基。除了METTL家族外,还有其他行使“Writers”功能的蛋白。
2) Erasers
m6A去甲基酶:有甲基化的添加肯定会有甲基化的去除,这些就依赖于去甲基酶的作用,现研究表明主要是FTO和ALKBH5两种。其中FTO的发现也证明了m6A修饰过程的可逆、动态。
m6A去甲基酶:在甲基化的过程中,除了甲基化的添加,还有一个重要的步骤,那就是甲基化的去除。目前研究主要集中在两种去甲基化酶上,分别是FTO和ALKBH5。FTO最初被发现与肥胖相关,因此也被称为“肥胖基因”,但它实际上是一种去甲基化酶,能够去除m6A甲基化修饰,证明m6A修饰过程的可逆性和动态性质。ALKBH5是一种与FTO类似的去甲基化酶,主要在生殖系统中高表达,对于生殖系统的发育和功能有着重要的作用。
3) Readers
m6A甲基化阅读蛋白:一种RNA结合蛋白,影响带有m6A修饰的mRNA的特定生物学功能。主要有YTHDF和YTHDC两种类型。YTHDF蛋白:普遍存在,能与带有m6A修饰的RNA结合,促进其翻译过程。缺乏会导致翻译水平下降,影响基因表达。也可影响RNA转录和加工过程。YTHDC蛋白:在神经系统中高度表达,能与带有m6A修饰的RNA结合。可特异性识别m6A修饰的RNA进行调控。也可影响RNA的稳定性和降解过程。
2. m6A修饰的作用机制
1) 参与染色质修饰调控
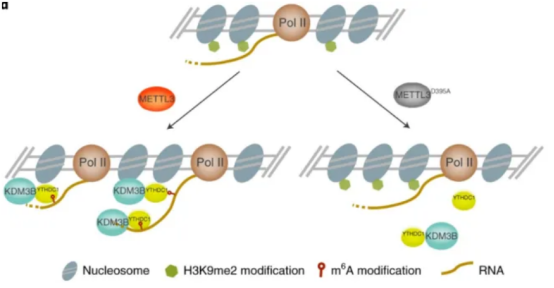
m6A RNA甲基化可调控多种组蛋白修饰,从而影响基因表达。反之,组蛋白修饰也可以通过共转录调控m6A RNA修饰。如METTL3或YTHDC1的缺失减少H3K9me2去甲基化酶KDM3B的结合,因此未能诱导H3K9me2去甲基化。
2) 参与染色质状态调控

m6A的修饰也参与了异染色质的形成和维持,这对于基因表达调控和基因组完整性至关重要。YTHDC1 可以招募 NEXT 复合物来靶向并降解 METTL3 介导的 m6A 标记的 carRNA 子集,最终调节附近的染色质状态和下游转录。
3) 参与基因转录调控
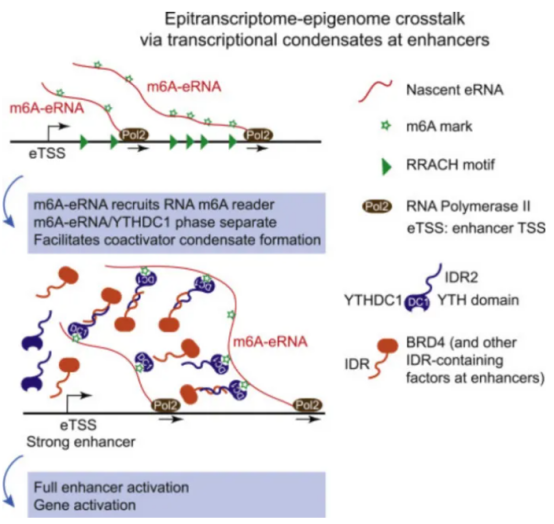
m6A修饰的eRNA在转录过程中扮演着重要的角色。这种修饰的eRNA可以在增强器附近招募YTHDC1,能够促进转录因子的凝聚。当YTHDC1与辅助因子BRD4结合时,它们形成了一个更大的转录因子凝聚体,这个凝聚体可以更有效地调节增强子活性和转录激活。m6A修饰的eRNA通过招募YTHDC1和促进其与BRD4的结合,成为了调节增强子活性和转录激活的关键因素。
4) 参与DNA同源重组修复
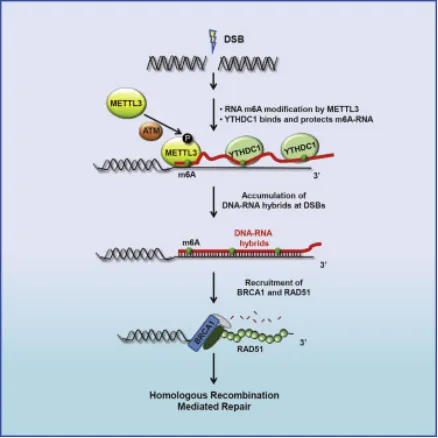
HR修复是一种细胞对DNA双链断裂(DSB)的自我保护措施。YTHDC1是可以促进m6A修饰的RNA的稳定性。在DNA损伤处,YTHDC1可以增加m6A标记的RNA:DNA杂合物的累积,并促进RAD51和BRCA1的招募,从而促进同源重组介导的DNA损伤修复(DSBR)。
5) 参与RNA加工和核输出
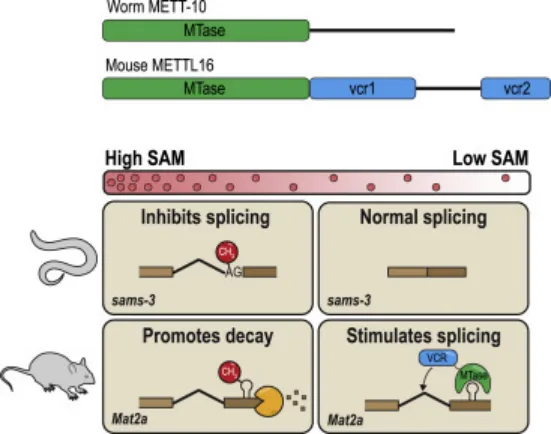
m6A在RNA上的沉积可以改变局部RNA的二级结构,从而影响细胞中RNA-蛋白质相互作用。线虫中3’剪接位点发生m6A甲基化,这阻止了剪接因子U2AF35识别内含子上的AG序列,从而抑制SAM合成酶pre-mRNA剪接,调控SAM稳态。
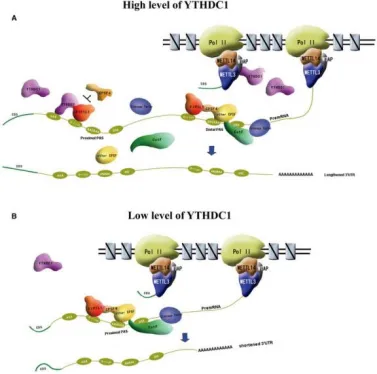
研究发现YTHDC1蛋白通过结合上游m6A位点,促进更长的3′-UTR转录本的产生,表明m6A修饰倾向于在远端APA位点进行添加。
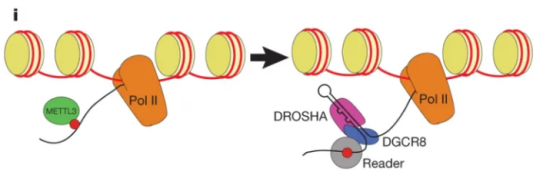
除此之外,m6A修饰在转录后阶段是诱导miRNA生物发生的关键修饰。m6A修饰可以影响pri-miRNA和pre-miRNA的剪接和成熟,从而影响miRNA的功能。研究表明,m6A修饰可以增加pri-miRNA的剪接效率,促进miRNA的成熟。
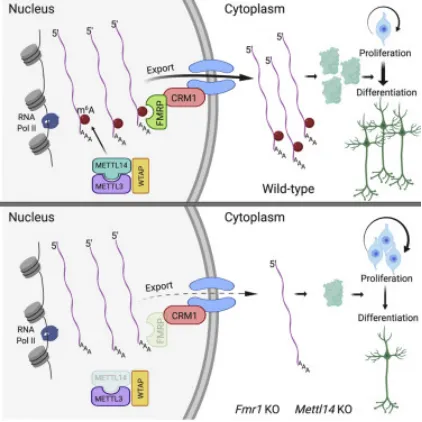
mRNA的核输出是连接细胞核转录与细胞质翻译的重要过程,可选择性调控基因表达。FMRP优先结合m6A修饰的RNA,并通过CRM1介导被甲基化的mRNA靶标的核输出。野生型FMRP可以修复核滞留缺陷,而核输出缺陷的FMRP则不能,这表明FMRP在神经分化过程中介导了m6A依赖的mRNA核输出的关键作用。
6) 参与mRNA翻译调控
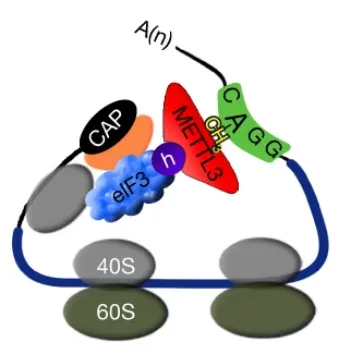
m6A修饰通过多种机制调控mRNA翻译为蛋白质。METTL3结合m6A序列,并与eIF3h相互作用来促进mRNA环化,从而帮助启动翻译。
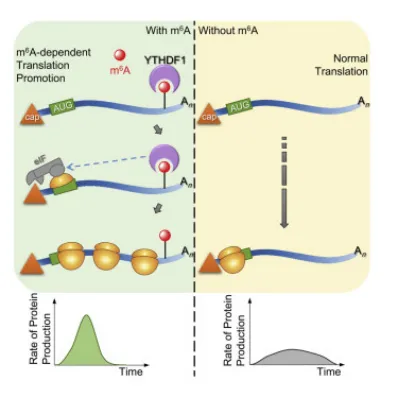
YTHDF1可以招募 eIF3,并将带有m6A标记的mRNA与核糖体结合,从而促进 cap-dependent翻译。
7) 参与RNA稳定性调控
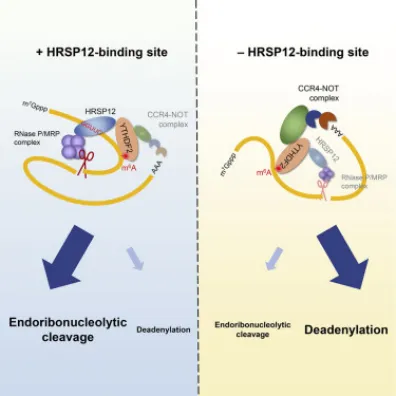
m6A可以招募降解蛋白或移除稳定蛋白来促进mRNA的降解,也可以促进mRNA的稳定。含有m6A的RNA通过YTHDF2招募HRSP12,HRSP12作为适配蛋白连接YTHDF2和RNase P/MRP,导致YTHDF2结合RNA的快速降解。
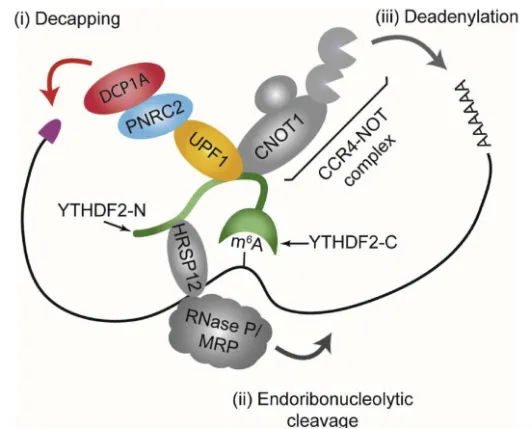
UPF1是无义介导的mRNA衰变的关键因子,与YTHDF2相互作用,从而触发m6A RNA的快速降解。
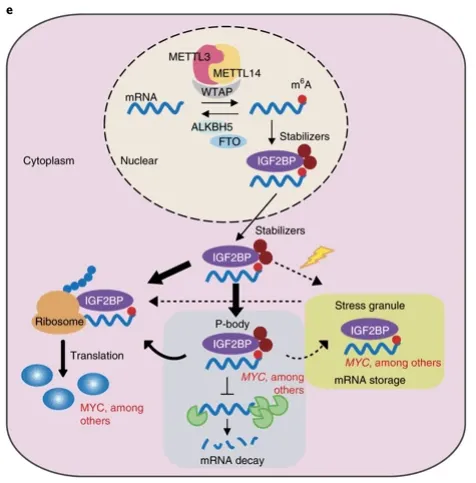
IGF2BPs作为一类独特的m6A读取器,通过识别 m6A序列来靶向mRNA转录本。与YTH DC家族蛋白促进mRNA降解的作用不同,IGF2BPs在正常和应激条件下通过m6A依赖性的方式促进其靶标mRNA的稳定性和储存,从而影响基因表达输出。
