1. 什么是空间蛋白质组学
传统针对大块组织(bulks)的蛋白质组学分析,在组织均质化过程中失去了空间分布与细胞类型信息,最终获得的质谱信号为组织或细胞裂解液中蛋白表达的平均水平。深度空间蛋白质组学技术,顾名思义,可以精细获得组织内不同细胞和功能区域的蛋白表达谱。通过将空间与细胞类型信息与蛋白质组数据联系起来,从而深入了解组织空间微环境并发现更精准的生物标志物和新的功能机制。
与其他空间组学技术相比,空间转录组学通过高度多重荧光原位杂交(FISH) 或基于测序的方法来获取空间信息,并基于转录组信息推断蛋白质的表达状态。然而mRNAs 和它们的同源蛋白之间的翻译,是高度调节和非线性的,RNA 表达并不能直接预测蛋白质表达。转录本表达与蛋白质相比具有更高的随机性,与同源 mRNA 相比,蛋白质的变异系数要低得多(下图)。因此通过直接测量空间维度蛋白质组数据,将更准确地反映特定的细胞功能和状态。
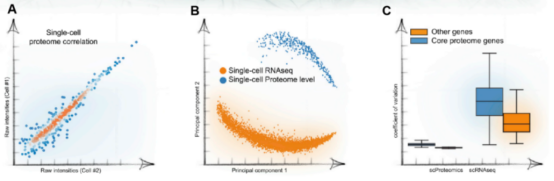
转录组与蛋白质组的比较
2. 技术原理
空间蛋白组技术原理如下图所示,其核心在于通过高精度激光捕获显微切割技术 (LCM) 技术切取感兴趣的组织区域或细胞,经过优化的超微量样本无损提取并酶切蛋白为肽段,进而使用高灵敏度质谱,分析蛋白在不同空间位置的表达特征。
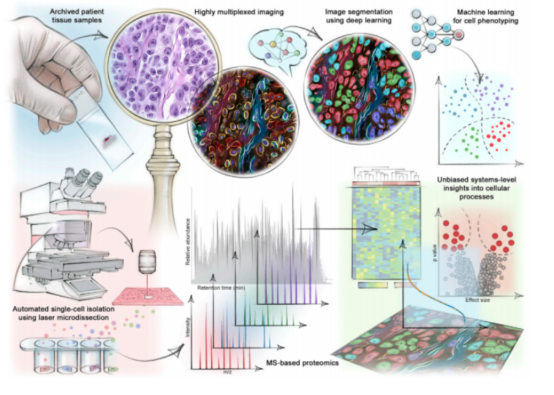
深度空间蛋白质组学流程示意
3. 技术
1)细胞级精细化区域精准切割
空间蛋白质组学技术,运用LCM技术在显微镜直视下从器官或组织切片中,按照指定的圈画区域准确获取某个特定的细胞群,其分辨率高至0.005~0.01mm2(约50个细胞)。通过细胞级的精细切割,和稳定无污染的收集,保障了空间蛋白质组研究的精细度和准确性。
2)高灵敏度蛋白组质谱定量
由于蛋白质无法类似DNA一样进行扩增,单个细胞仅包含约150 pg的蛋白质。因此,与其他空间组学技术相比,超微量样本下的空间蛋白质组的分析更具有挑战性。超高灵敏度色质谱技术的兴起,尤其是基于timsTOF Pro的全新一代4D蛋白质组技术,使空间蛋白质组分析成为可能。景杰生物空间蛋白组技术,基于4D质谱平台,能在0.01 mm2×10 μm的常规组织样本(约50~100个细胞)中,平均检测深度均大于2000个蛋白,高精度、高深度、高重复性地呈现空间微尺度分子景观。

基于LCM+高灵敏度质谱的空间蛋白质组学分析
4. 应用领域
空间蛋白质组学技术,开辟了解析组织微环境、组织生物标记物开发、疾病诊断与预后、以及精准医疗等领域全新的研究视角。
1)疾病关键靶点与生物标志物:空间蛋白质组学直接从其天然组织环境中比较和对比单一的细胞类型和状态,可获取到蛋白组对应的细胞类型与空间信息 ,能够找到更精准的疾病关键靶标蛋白及诊治生物标志物。如Nature正刊发表的题为“Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts”的文章,针对卵巢癌以及卵巢癌附近基质开展空间蛋白质组学分析,成功揭示了NNMT作为基质细胞对肿瘤转移的关键调控靶点,也为未来有针对的卵巢癌转移靶向治疗提供了新的思路。
2)肿瘤异质性与发展过程:在精确肿瘤学的背景下,获取空间多组学图谱可以以整体方式重建肿瘤发生的关键过程 。如发表在Nature Biotechnology(IF=54.91)上题为“Deep Visual Proteomics defines single-cell identity and heterogeneity”的文章中。空间蛋白组技术能区别具有特异性表型的细胞,并借助蛋白组学分析该细胞的潜在功能。在黑色素瘤组织中精确分析出仅在肿瘤区域中出现的与免疫调控和DNA复制相关的特征性蛋白。这使得跨二维组织切片的癌症进展的失调关键途径的可视化成为可能。
3)空间蛋白组图谱研究:蛋白质是细胞功能的承担者,为空间组学与生物学增加一个重要的维度。针对重要器官的正常组织样本的空间蛋白组分析,有助于绘制细胞类型特异性细胞图谱及器官发育轨迹。如发表在Nature Communications(IF=17.694)上题为“Spatially resolved proteomic map shows that extracellular matrix regulates epidermal growth”的最新成果。运用基于质谱的空间蛋白质组学技术构建了分层皮肤蛋白质图谱,并对二期梅毒患者皮肤组织进行精细分析,提供了对ECM蛋白促进EpSC生长和功能的见解。该研究有利于未来皮肤溃疡或涉及表皮细胞功能障碍和再上皮化阻滞的难治性病变疾病的临床治疗。
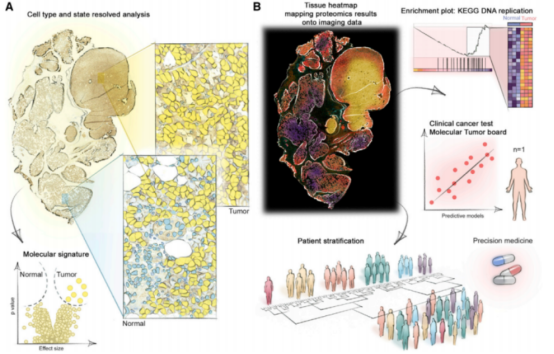
空间蛋白质组学在患者表型分析中的临床应用
