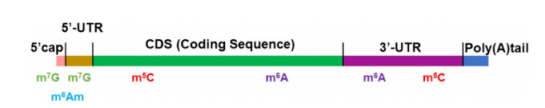
目前在RNA中发现了超过170种修饰,包括m6A、m5C和m7G。它们通过作用于RNA的三级结构、生物发生、定位和功能,增加了RNA物种的复杂性。
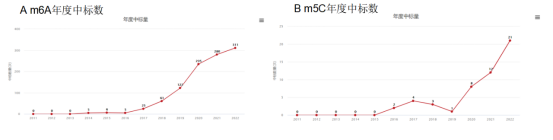
在这些修饰中,m6A在近三年国自然申请中炙手可热,已逐渐显露出泛滥之势,竞争十分激烈,但是另一种m5C却在2020-2022年中标数量逐年升高,且还处于爬升阶段。
1. m5C概述
m5C修饰是指供体的一个活性甲基被添加到RNA中胞嘧啶碱基的第5位碳,它是一种广泛存在的RNA修饰,在mRNA和非编码RNA中都有检测到,包括tRNA、rRNA、snRNA和eRNA等。在tRNA中,m5C可以维持稳态,优化密码子-反密码子配对,调节应激反应,并控制翻译效率。
mRNA m5C修饰与mRNA的稳定性、剪接和核浆转运,DNA损伤修复,增殖和迁移,干细胞的发育、分化和重编程等各种生物过程有关。
异常的mRNA m5C修饰与多种疾病的病因有关,包括动脉硬化、自身免疫性疾病和癌症。
2. m5C修饰工具酶
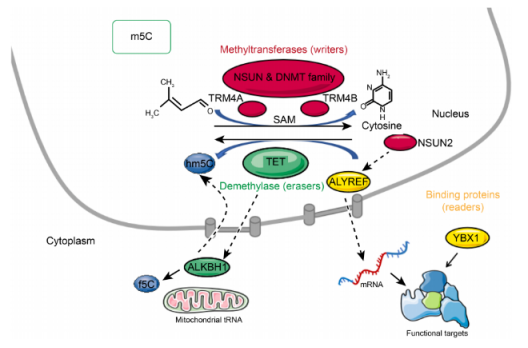
m5C 修饰主要由3种类型的蛋白质介导,分别是甲基转移酶(writer)、去甲基化酶(eraser)和阅读蛋白(reader)。
1)甲基转移酶(writer)
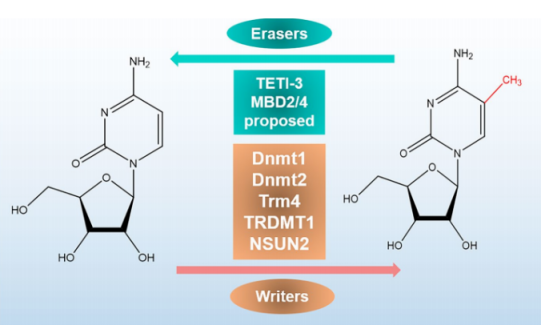
m5C的甲基转移酶(RCMTs)利用腺苷甲硫氨酸作为甲基供体,将甲基转移到胞嘧啶上形成m5C。目前已经发现了10多种类型的RNA m5C甲基转移酶,包括DNMT2、TRDMT家族成员、NSUN家族。其中,NSUN甲基转移酶包括几个成员:NSUN1到NSUN7 和NSUN5a/b/c。其中最明确的是NSUN2(Trm4)。DNMT2和NSUN2具有互补的靶点特性。
拟南芥中的TRDMT家族包括TRM4A和TRM4B。
2)去甲基化酶(eraser)
蛋白质去甲基化酶(如TET酶家族)通过介导RNA的去甲基化使其具有可逆性。TET1-3具有作为RNA去甲基化酶的潜力,其过表达可以显著提高HEK293T细胞中RNA 5hmC的水平。
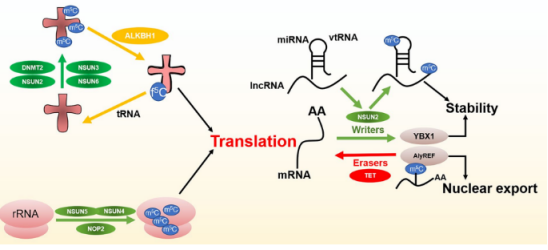
有研究发现,线粒体DNA和RNA双加氧酶ALKBH1也参与了细胞质tRNAs的去甲基化。ALKBH1的缺失导致线粒体翻译和耗氧量的严重防御,说明ALKBH1的RNA m5C代谢在调节线粒体活性方面具有很大的潜力。
3)阅读蛋白(reader)
RNA m5C结合蛋白,如ALYREF和YBX1,通过识别并结合m5 C位点发挥生物学效应。
ALYREF是细胞核中识别的第一个mRNA阅读蛋白,具有K171的关键m5C识别位点。m5C通过在细胞核中的病毒RNA转录本被m5C阅读蛋白ALYREF识别,这有助于输出到细胞质。
YBX1在人细胞中被鉴定为细胞质m5C阅读蛋白。YBX1专门靶向几种含有m5C的致癌基因,如HDGF,并促进这些致癌基因的稳定性和癌症进展。87.8%的m5C修饰的mRNA被YBX1识别出来。
3.文章案例
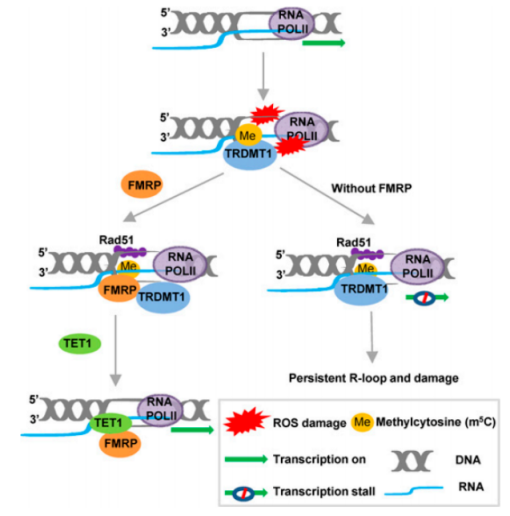
FMRP通过促进TET1介导的m5C RNA修饰去甲基化来促进转录偶联的同源重组
2022年2月14日,南京医科大学在PNAS(Q1区,IF:11.1)上发表了题为 FMRP promotes transcription-coupled homologous recombination via facilitating TET1-mediated m5C RNA modification demethylations的研究论文。
该研究揭示了m5C reader FMRP协调m5C writer TRDMT1和eraser TET1转录偶联同源重组,促进癌细胞mRNA依赖性的修复和细胞存活。

RNA甲基转移酶TRDMT1在转录区域DNA双链断裂(DSB)处的mRNA上生成m5C,促进转录偶联同源重组(HR)。该研究发现脆性X智力迟钝蛋白(FMRP)通过m5C writer TRDMT1和m5C eraser TET1相互作用促进转录偶联HR。
TRDMT1、FMRP和TET1在DSB转录活性位点按时间顺序起作用。FMRP对含有m5C修饰RNA的DNA:RNA杂链亲和力高于未修饰的杂链,并促进TET1在体外对m5C进行去甲基化,且FMRP是R环解决必需的。
未解决的R环和m5C阻止DSB修复,FMRP缺失导致DSB在转录活性位点修复延迟,表明m5C reader FMRP协调m5C writer和eraser,促进癌细胞mRNA依赖性的修复和细胞存活。